- Лекарственная устойчивость к туберкулезу
- Виды лекарственной устойчивости микобактерий туберкулеза
- Современная стратегия лечения лекарственно-устойчивого ТУБЕРКУЛЕЗА ЛЕГКИХ
- Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
- Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
- Литература
Лекарственная устойчивость к туберкулезу
По инициативе ВОЗ с 1993 года туберкулез был объявлен национальным бедствием, а 24 марта стало ежегодным Всемирным днем борьбы с туберкулезом.
Терминология лекарственно-устойчивого туберкулеза.
Распространены 3 термина: ЛУТ, МЛУ-ТБ, ШЛУ-ТБ.
ЛУТ (лекарственно-устойчивый туберкулез) — туберкулез с устойчивостью высеянных микобактерий как минимум к 1 лекарственному препарату.
МЛУ-ТБ (множественная лекарственная устойчивость) — туберкулез с устойчивостью к 2 наиболее эффективным противотуберкулезным препаратам (изониазиду и рифампицину). МЛУ имеют 32% впервые заболевших и 76% больных с рецидивом туберкулеза.
ШЛУ-ТБ (широкая лекарственная устойчивость) — туберкулез с МЛУ и дополнительной устойчивостью ко всемфторхинолонам и к 1 из 3 антибиотиков группы аминогликозидов (капреомицину, канамицину или амикацину).
Абсолютный ЛУТ — устойчивость ко всем применяемым препаратам. В Беларуси диагностируется почти у 50% пациентов с ШЛУ-ТБ.
Причины устойчивости микобактерий.
Появление устойчивости к антибактериальным препаратам — естественный биологический процесс, возможный благодаря мутации генов бактерий. В итоге мутантная бактерия выживает и дает начало новой колонии устойчивых бактерий. Также бактерии способны обмениваться генами.
Распространению устойчивых микобактерий способствовали:
дефекты лечения (перерывы, прием в неполной дозе, прием только 1 препарата и т.д.),
«почивание на лаврах» в 1970-80 гг., когда туберкулез в Беларуси считался почти побежденным, а фармакологи прекратили поиск новых противотуберкулезных средств. В 1990-х годах это привело к большим проблемам.
Особенности лечения туберкулеза.
Лечение чувствительного туберкулеза длится 6-8 месяцев, в первые 2 месяца назначается 4 препарата.
Лечение МЛУ-ТБ длится от 20 до 36 месяцев (2-3 года), а ШЛУ-ТБ — минимум 36 месяцев. В обоих случаях изначально назначается по 5-6 препаратов сразу. Для лечения такого туберкулеза фтизиатры снова используют лекарства, от которых по разным причинам отказались в прошлые десятилетия.
Каждый случай лекарственно-устойчивого туберкулеза рассматривается на консилиуме врачей. Обычно у таких больных много сопутствующих болезней.
Профилактика возникновения лекарственной устойчивости у пациентов с МЛУ-ТБ заключается в строгом контроле лечения на всех этапах (дома, амбулаторно, в стационаре). Лечение одного пациента с МЛУ стоит от 5 тысяч долларов. Помогает Глобальный фонд по борьбе со малярией, туберкулезом и СПИДом.
Абсолютный ЛУТ лечится альтернативными методами. Например, с помощью коллапсотерапии: в грудную полость вводится воздух, легкое сжимается, сдавливается, в патологическом очаге происходит заживление. Хирургическое лечение — удаление пораженной части легкого.
Распространенность туберкулеза в Беларуси
Беларусь входит в число 18 европейских стран, неблагополучных по туберкулезу. Здесь относительно высокая распространенность МЛУ-ТБ, но ситуация лучше, чем в России и на Украине. В последние годы заболеваемость и смертность от туберкулеза снижаются.
Диагностика туберкулеза.
жалуется на кашель дольше 3 недель,
лихорадку (повышенную температуру),
то нужно обязательно взять анализ мокроты на микобактерии туберкулеза.
Быстрое обнаружение и диагностика устойчивости микобактерий проводится в противотуберкулезных учреждениях с помощью молекулярно-генетических методов (ПЦР, LPA, GeneXpert) в течение нескольких часов. Раньше на это требовалось около 3 месяцев, т.к. микобактерии растут очень медленно. В перспективе экспресс-методы будут доступны и в лабораториях общелечебной сети.
Задача врачей широкого профиля — заподозрить туберкулез и выявить его на начальном этапе. Благодаря гранту Глобального фонда совместно со специалистами РНПЦ пульмонологии и фтизиатрии проводится постоянное обучение врачей разного профиля.
Кто болеет туберкулезом.
В 2015 году в Беларуси заболело 3 тысячи 35 человек (в том числе 56 медработников, из них по Минской области 7 случаев).
Заболеть может любой. 80% больных — в трудоспособном возрасте, большинство — мужчины (это обусловлено частым употреблением алкоголя и курением). Особенно высок риск при ослаблении иммунитета, этому способствуют:
низкий уровень жизни,
тяжелые условия работы,
Риск возрастает также при сахарном диабете, ВИЧ-инфекции, приеме глюкортикоидов и цитостатиков.
Нужна ли вакцинация от туберкулеза?
Нужна из-за высокой распространенности туберкулеза. Вакцина живая, поэтому требуется точное соблюдение всех правил прививки. Вакцина защищает только от генерализованных (распространенных по организму) форм инфекции. В случае болезни привитый ребенок переболеет в более легкой форме.
Перспективы борьбы с ЛУТ
Разработаны качественно новые лекарства: бедаквелин,имипенем+циластатин,деламанид.
Создание более совершенных вакцин, создающих стойкий иммунитет.
Источник
Виды лекарственной устойчивости микобактерий туберкулеза
Устойчивость возбудителя туберкулеза к препаратам, используемым для лечения, и особенно множественная лекарственная устойчивость (МЛУ), во многих странах стала серьезной проблемой общественного здравоохранения, препятствующей эффективной борьбе с туберкулезом [3; 4].
По оценкам Всемирной организации здравоохранения в 2012г около 3,7% впервые выявленных больных туберкулезом выделяли штаммы микобактерий с множественной лекарственной устойчивостью. Среди ранее получавших лечение больных уровни МЛУ гораздо более высокие – около 20%. В 2011 г. среди всех случаев заболевания туберкулезом было от 220 000 до 400 000 случаев заболевания туберкулезом с МЛУ. Около 60% этих случаев приходилось на страны БРИКС (Бразилию, Российскую Федерацию, Индию, Китай и Южно-Африканскую Республику) [9].
На территории Сибири и Дальнего Востока наблюдался самый высокий уровень регистрируемого числа случаев туберкулеза с множественной лекарственной устойчивостью среди впервые выявленных больных [6; 8].
Уровень первичной лекарственной устойчивости характеризует часть микобактериальной популяции, циркулирующей на территории, и этот показатель чрезвычайно важен для оценки степени напряженности эпидемической ситуации [2; 7].
Лекарственная устойчивость имеет не только клиническое значение, связанное с увеличением продолжительности лечения дорогостоящими препаратами, вызывающими серьезные побочные реакции, но и крайне важное эпидемиологическое значение. Доказано, что эпидемические очаги туберкулеза, сформированные бактериовыделителями устойчивых к противотуберкулезным препаратам микобактерий, представляют собой территории особого риска заболевания контактных лиц. Недостаточная эффективность химиопрофилактики в очагах туберкулеза с МЛУ способствует формированию очаговости с высоким уровнем заболеваемости контактных лиц [5].
В системе эпидемиологического надзора за туберкулезной инфекцией изучение характеристик циркулирующих штаммов микобактерий туберкулеза (МБТ) позволяет адекватно воздействовать на составляющие эпидемического процесса [1].
Цель исследования: качественная характеристика циркулирующих на территории Омской области штаммов M. tuberculosis, а также краткосрочное прогнозирование заболеваемости населения туберкулезом с множественной лекарственной устойчивостью.
Материалы и методы
В основу ретроспективного эпидемиологического исследования положены наблюдения за эпидемическим процессом туберкулезной инфекции в Омской области за период 2004 – 2013 гг. Материалом для исследования послужили сведения форм федерального статистического наблюдения №2 «Сведения об инфекционных и паразитарных заболеваниях» и №33 «Сведения о больных туберкулезом», а также данные бактериограмм впервые выявленных больных туберкулезом. Выравнивание динамических рядов показателей осуществлялось по методу наименьших квадратов. Уровень и структура заболеваемости и ее исходов оценивались по интенсивным (инцидентности, превалентности) и экстенсивным показателям (показателей доли).
Характеристика частоты, структуры и спектра лекарственной устойчивости МБТ получена в ходе поперечного эпидемиологического исследования, объектами которого послужили впервые выявленные больные туберкулезом органов дыхания, находившиеся под диспансерным наблюдением в КУЗОО «Туберкулезная больница». Основную группу составили 122 больных туберкулезом, выявленных в период с января 2012 по декабрь 2013г. Для оценки динамики изменения характеристик лекарственной устойчивости подобрана контрольная группа – 89 больных, выявленных с января по декабрь 2008г. У всех больных, включенных в исследование, было установлено бактериовыделение М. tuberculosis бактериологическим методом (посев мокроты и определение лекарственной устойчивости методом абсолютных концентраций на плотной яичной питательной среде Левенштейна-Йенсена). Использовались следующие критические концентрации противотуберкулезных препаратов, которые содержались в питательной среде – стрептомицин (S) – 10 мкг/мл, изониазид (H)- 1 мкг/мл, рифампицин (R) – 40 мкг/мл, этамбутол -2 мкг/мл, офлоксацин (Of) — 2 мкг/мл, канамицин – 30 мкг/мл.
Оценка статистической значимости различий результатов исследования в сравниваемых группах была проведена с помощью критерия Пирсона χ2 (хи-квадрат). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимался равным 0,05. Статистический анализ осуществлялся с использованием возможностей МS Excel, STATISTICA 7.0.
Результаты и обсуждение
На территории Омской области за исследуемый период наблюдалось некоторое улучшение ряда эпидемиологических показателей, характеризующих эпидемический процесс туберкулезной инфекции, что выражалось в наметившейся тенденции к снижению заболеваемости, распространенности и смертности населения от туберкулеза.
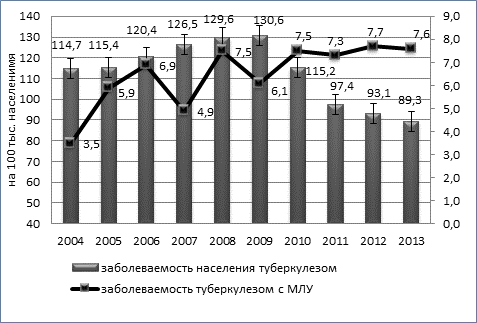
Вместе с тем сохранялся значительный уровень заболеваемости населения туберкулезом органов дыхания с бактериовыделением — 44,0 на 100 тысяч населения (95% ДИ 41,0÷46,9). Распространенность туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ) возросла с 20,7 (95% ДИ 18,7÷22,6) до 40,4 на 100 тысяч населения (95% ДИ 37,6÷43,2). Хотя за указанный период смертность населения от туберкулеза снизилась (с 25,8 до 11,4 на 100 тысяч населения, T сн.=-3,47%), в структуре смертности ежегодно увеличивался удельный вес умерших, страдавших туберкулезом с МЛУ – с 10,7% (N= 468; n=50; ДИ 2,2÷19,2) в 2004г до 51,5% в 2013г.(N=227; n=117; ДИ 42,4÷60,5) (p=0,000).
Динамика заболеваемости туберкулезом органов дыхания с множественной лекарственной устойчивостью имела умеренную тенденцию к росту (Тпр. = 2,7%). Заболеваемость МЛУ-ТБ возросла практически в 2 раза с 3,5 (95% ДИ 2,7÷4,3) до 7,6 на 100 тысяч населения (95% ДИ 6,3÷8,8), причем рост заболеваемости МЛУ-ТБ происходил на фоне умеренной тенденции (Тсн.=-1,43%) к снижению общей заболеваемости населения туберкулезом (рисунок).
Динамика заболеваемости туберкулезом населения Омской области и заболеваемости туберкулезом с множественной лекарственной устойчивостью возбудителя (на 100 тыс. населения), 2004-2013гг.
К концу наблюдаемого периода доля больных с первичной МЛУ среди обследованных больных составляла 22,0% (N=685; n=151; ДИ 15,4÷28,6), доля приобретенной в процессе лечения множественной лекарственной устойчивости в контингенте больных — бактериовыделителей – 49,6% (N=326; n=162; ДИ 41,9÷57,3).
Нами изучена качественная характеристика бактериовыделения в контингенте впервые выявленных больных туберкулезом органов дыхания. Как показали результаты исследования, в основной группе лекарственная устойчивость к одному и более противотуберкулезных препаратов была обнаружена у 52,5% (N=122; n=64; ДИ 40,3÷64,7) впервые выявленных больных туберкулезом. В структуре лекарственной устойчивости монорезистентными (устойчивыми к одному из ПТП) были 9,4% выделенных штаммов, множественная лекарственная устойчивость определена в 59,4% случаев, полирезистентыми (устойчивыми к комбинации различных ПТП, кроме одновременной к изониазиду и рифампицину) были 31,2% штаммов (таблица).
Структура первичной лекарственной устойчивости штаммов М. tuberculosis, выделенных у впервые выявленных больных туберкулезом органов дыхания
Источник
Современная стратегия лечения лекарственно-устойчивого ТУБЕРКУЛЕЗА ЛЕГКИХ
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый вариант мы определяем как лекарственно- чувствительный туберкулез легких (ЛЧТЛ), вызванный микобактериями туберкулеза (МБТ), чувствительными ко всем противотуберкулезным препаратам (ПТП). ЛЧТЛ встречается в основном у впервые выявленных и реже у рецидивных больных. На чувствительные МБТ бактерицидно действуют основные ПТП: изониазид, рифампицин, пиразинамид, стрептомицин и/или этамбутол. Поэтому в настоящее время для наиболее эффективного лечения лекарственно-устойчивого туберкулеза легких (ЛУТЛ) с учетом влияния химиопрепаратов на микобактериальную популяцию, чувствительную к ПТП, Международный союз по борьбе с туберкулезом и другими заболеваниями легких (МСБТЛЗ) и ВОЗ предлагают двухэтапные укороченные курсы комбинированной химиотерапии под непосредственным медицинским наблюдением [1].
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
 |
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Прямой метод определения ЛР МБТ осуществляется путем непосредственного посева мокроты на твердые питательные среды с добавлением определенных концентраций ПТП (см. табл.). Результаты прямого микробиологического метода определения лекарственной устойчивости МБТ учитываются на 21 — 28-й день, что позволяет в этот срок провести коррекцию химиотерапии.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
Переносимость препарата была хорошей. Только у одного больного через месяц применения было выявлено транзиторное повышение «печеночных» трансаминаз при отсутствии клинических проявлений поражений печени. Печеночные тесты нормализовались без отмены препарата при назначении гепатопротекторов.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
Источник