Лекция №10
«Спирты. Аминоспирты, их производные»
Спирты – это углеводороды, у которых один или несколько атомов «Н» замещены на группу «ОН» (гидроксильную).
Группа «ОН» — функциональная группа спиртов.
Общая формула R-(OH)n
Спирты называют еще алкоголяты.
Классификация спиртов.
I.По количеству «ОН» спирты бывают:
а) одноатомные CH3-CH2-OH – этанол
б) двухатомные СН2-СН2 — этандиол
в) трехатомные СН2 – OH
СН — OH — пентантриол
II.По радикалу «R» спирты бывают:
а) предельные CH3-OH — метанол
б) непредельные CH2=CH-CH-CH3 — бутенол 1




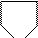
— СН2-ОН фурановый спирт
III.По расположению группы «ОН»:
б) вторичные CH3-CH-CH3 пропанол 2
в) третичные CH3-C-CH3 2 метилпропанол 2
В свободном состоянии спирты не встречаются, исключение составляет метанол CH3-OH (древесный уголь).
Однако в соединении с кислотами спирты встречаются довольно часто в виде сложных эфиров.
Плотность всех спиртов меньше 1, т.е. они легче воды. Первые представители ряда спиртов смешиваются с водой в любых отношениях, но с ростом углеродного скелета растворимость падает. Твёрдые спирты С15Н31ОН (цитиловый) плохо растворимы в воде.
Низшие спирты имеют приятный запах, средние спирты имеют неприятный запах, а высшие спирты запаха не имеют.
Фармакопейный интерес представляет этиловый спирт СН3-СН2-ОН Spiritus vini.
Получение:
Существует 2 способа получения:
1) биохимический – брожение. Осуществляется с участием ряда ферментов. Сбраживанию подвергаются моносахариды и полисахариды.
Полученный таким образом спирт носит название спирт-сырец. Его очищают, после чего он носит название спирт-ректификат.
2) химический (синтетический):
а) гидратация алкенов
б) из галоген-производных
R-Cl + NaOH → R-OH + NaCl
Этанол обладает приятным запахом и вкусом. Абсолютный спирт готовят при пропускании С2Н5ОН через негашеную известь (СаО) и сульфат меди (СuSO4).
В фармации концентрацию С2Н5ОН выражают в процентах (%). Объемные проценты называют градусами.
Подлинность:
(уксусно-этиловый), фруктовый запах
Применяют:
— для приготовления настоек,
— как обеззараживающее средство в хирургии.
Этанол в небольших дозах действует опьяняюще, в больших дозах вызывает состояние, близкое к наркозу, иногда заканчивающееся летальным исходом.
В фармации широкое применение находит пропантриол или глицерин.
Он был открыт в 18 веке при приготовлении пластыря. В природе широко встречается в виде сложных эфиров высших органических кислот. В настоящее время его получают из пропилена (СН2=СН-СН3).
Глицерин – бесцветная, густая жидкость, сладкая на вкус, растворима в воде, спирте; нерастворима в эфире, хлороформе. Глицерин обладает слабыми кислотными свойствами.
Количественное определение: купринометрический метод.
Наибольшее количество глицерина идет на получение нитрата глицерина.
Нитроглицерин – тринитрат глицерина.
Реакция получения нитроглицерина:
Тринитрат глицерина – тяжелая маслянистая жидкость сладкого вкуса, нерастворима в воде, но растворима в органических растворителях. При легком ударе, сотрясении, при нагревании – взрывается. Глицерин очень ядовит, но в малых дозах ценное лекарственное средство (обладает сосудорасширяющим действием). Хранят по списку «А», в прохладном месте, в проветриваемом помещении.
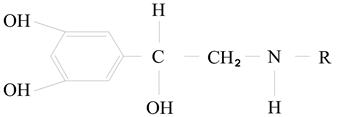
Аминоспирты – производные фенилалкиламинов и их синтетических аналогов. Все Аминоспирты относятся к группе алкалоидов и выполняют важную роль в организме; в качестве структурных компонентов Аминоспирты содержат пирокатехин (катехоламин).
Обладает биогенным действием и образуется в организме в результате метаболизма. К аминоспиртам относятся: дофамин, норадреналин, адреналин. В организме выполняют роль нейромедиаторов.
Адреналин – гормон мозгового вещества надпочечников, а дофамин и норадреналин — его предшественники. Впервые адреналин выделил русский ученый Цибульский в конце 19 века, а в 1903 году установлена его химическая формула. После адреналина установили формулу норадреналина.
Сырье для получения – надпочечники скота. Гормоны (кортикостероиды) выделяют этанолом, извлекают дихлорэтаном, а в подкисленном состоянии остаются адреналин гидрохлорид и другие, которые осаждают ацетатом свинца. Очистка адреналина – обработка раствором аммиака, потом винной кислотой и получают адреналин тартрат.
В медицине применяют: адреналин гидротартрат – Adrenalini hydrotartrat:
Норадреналин – Noradrenalini hydrotartrat:
Физические свойства: белые или слегка сероватые порошки без запаха. В медицинской практике применяют аналоги: мезатон и изадрин.
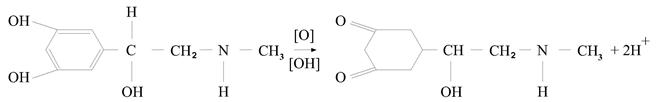
Наличие в молекуле адреналина 2-х ассиметричных атомов углерода обуславливает существование оптических изомеров. Применение находят как D- так и L-изомеры: L-изомеры в 12 раз активнее D-. Наличие первичной формы (норадреналин) или вторичной формы (адреналин) обуславливает их основные свойства и способность образовывать соли, в виде которых они и применяются в медицине. Соли гидрохлориды и гидротартраты получаются друг из друга (замена винной кислоты на соляную и наоборот). Продукты растворимы в воде, нерастворимы в хлороформе, эфире, малорастворимы в этаноле. Как фенолы дают качественную реакцию образования фенолятов. Способны окисляться под действием «О» и света, образует окрашенные продукты окисления.

Цветные реакции на адреналин и его аналоги основаны на окислении продуктов:
1) НТД рекомендует цветную реакцию с FeCl3 – изумрудно-зеленое окрашивание, которое переходит в вишнево-красное под действием аммиака. Мезатон даст фиолетовый цвет.
2) Адреналин и норадреналин восстанавливают серебром и аммиачным раствором, дают положительную реакцию с реактивом Фелинга.
3) Адреналин + 1,2 динитробензол – реакция основана на окислении продуктов в щелочной среде, окислением продуктов в ортохинон.
Добавление щелочи дает желто-зеленую флюоресценцию.
4) Под действием хлорамина изадрин — малиновое окрашивание, а мезатон — желтое.
5) Адреналин и норадреналин можно отличить друг от друга по реакции окисления 0, 1 М раствором йода в 2 М буферного раствора. Один буферный раствор рН= 3,5, а другой рН= 6,5. Адреналин – кремово-красное окрашивание. Норадреналин – красно-фиолетовое окрашивание.
6) Все продукты вступают в реакцию азосочетания с образованием окрашенных азосоединений:
1) с альфонитроза β-нафтанолом – красно-бурое окрашивание;
2) с KIO3 в кислой среде – вишнево-красное окрашивание;
3) с нингидрином – желтое (мезатон — красно-фиолетовое).
7) Используют: спектрофотометрический метод.
Количественное определение: по ГФ определение проводят методом неводного титрирования: в среде ледяной уксусной кислоты титруют 0,1 М раствором HClO4 – хлорной кислоты с индикатором кристаллическо-фиолетового или метиленового фиолетового.
Мезатон – броматометрический метод. Мезатон и Изадрин можно определять аргентометрией, т.к. они гидрохлориды.
Хранение: список Б, в защищенном от света месте, в хорошо укупоренной таре из оранжевого стекла или в запаянных ампулах. Для стабилизации к инъекционным растворам адреналина и норадреналина добавляют 0,1% натрия бисульфита, т.к. он обладает восстановительными свойствами.
Применение: в качестве сосудосуживающих средств, адреналин и мезатон расширяют зрачок. Адреналин участвует в регуляции сердечной деятельности, обмене углеводов, выделяется в кровь при стрессе, при снижении АД в результате травм, отравлений, для уменьшения кровотечения при кровопотере.
Мезатон – порошок или раствор для лечения ЛОР-заболеваний.
Изадрин – бронхорасширяющее средство при бронхиальной астме – ингаляция и в таблетках.
Структурно близки к катехоламину некоторые природные и синтетические биологически-активные лекарственные средства.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
ТЕМА: «КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ АМИНОСПИРТОВ, АРОМАТИЧЕСКИХ КИСЛОТ И ФЕНОЛОКИСЛОТ»
ЛЕКЦИЯ №18
ТЕМА: «КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ АМИНОСПИРТОВ, АРОМАТИЧЕСКИХ КИСЛОТ И ФЕНОЛОКИСЛОТ»
ПЛАН:
Общая характеристика групп.
Эфедрина гидрохлорид, адреналина гидротартрат, раствор адреналина гидрохлорида.
Бензойная кислота, натрия бензоат.
Салициловая кислота, натрия салицилат.
Эфиры салициловой кислоты,ацетилсалициловая кислота.
Эфедрин
Ephedrini hydrochloridum










L – 1- фенил-2-метиламинопропанол –1 гидрохлорид
Эфедрин алкалоид находится в различных видах эфедры, которая широко распространена в умеренных и субтропических зонах земного шара. Растения, содержащие эфедрин, использовались в медицине с глубокой древности. Так, за 300 лет до нашей эры Ephedra vulgaris (морской хвощ)применялась при кашле и высокой температуре. Как было выяснено позже, специфическое действие этого растения обуславливается наличием в нем алкалоида эфедры.
Забайкальская эфедра – Ephedra monosterma.
Но естественных запасов для получения мало и получают синтетическим путем. Полный синтез осуществлен Шпетом в 1925 году.
Строение и свойства эфедрина изучил отечественный ученый Массагетов П.С. Синтез осуществлен во ВНИХФИ Проскурниной Н.В. в 1934 году.
Получение:
Реакция Фриделя и Крафтса.










ВТОРИЧНЫЙ АМИН ЭФЕДРИН
После обработки HCL дает гидрохлорид.
Свойства:
Бесцветные игольчатые кристаллы или белый кристаллический порошок без запаха, горького вкуса.
Растворимость: легко растворим в воде, растворим в 95% спирте, не растворим в эфире, хлороформе.
Подлинность:
1. Ультрафиолетовый спектр 0,05% раствора.
2. 0,01 препарата растворяют в 1 мл воды +0,1 мл CuSO4 + 1 мл NaOH появляется синее окрашивание. При взбалтывании этого раствора с 1 мл эфира эфирный слой окрашивается в лилово-розовый цвет, водный – в синий.
3. По ГФ X 0.05 препарата растворяют в 1 мл воды + феррицианид калия и нагревают до кипения ; появляется запах бензальдегида (горького миндаля)












4. На хлориды – характерная реакция.
Чисотота:
— Предел кислотности, органические примеси, SO4 2- ,
— Прозрачность и цветность
— Соли аммония, сульфаты, органические примеси
— Потеря в массе при высушивании
Количественное определение:
- Неводное титрование. 0,1 препарата растворяют в 1 мл муравьиной кислоты + 10 мл уксусного ангидрида и титруют 0,1 N раствором хлорной кислоты до голубого окрашивания , индикатор кристаллический фиолетовый.
- Аргентометрически в присутствии уксусной кислоты с потенциометрической фиксацией конца титрования.
- Метод нейтрализации.
Применение:
Симпатомиметическое средство. Относится к адреномиметическим средствам, оказывающим сосудосуживающее и бронхорасширяющее действие. Применяется как возбуждающее средство на ЦНС, повышает артериальное давление, при бронхиальной астме, коклюше, крапивнице, недержании мочи, отравлении наркотическими и снотворными средствами.
Применение при пониженном артериальном давлении связано с сосудосуживающим действием.
По сравнению с адреналином оказывает более продолжительное и менее резкое действие , более стоек, может применяться per os.
Выпускается в порошках, таблетках 0,025, в ампулах 5% -1мл.
Хранение:
Список Б, в хорошо укупоренной таре в темном месте.
ВРД 0,05
Срок годности 5 лет.

L –1-( 3′,4′- диоксифенил)- 2 метил аминоэтанола гидротартрат
Адреналин – гормон надпочечников. Открыт русским ученым Цибульским Н.О. в 1895 году, в химическом отношении адреналин является ароматическим амином, в его основе лежит ядро пирокатехина. Синтез осуществлен в 1903 году.

Получение:






















АДРЕНАЛОН СИНТЕТИЧЕСКИЙ ИЗОМЕР-РАЦЕМАТ
HO C H
Свойства:
Белый или белый с сероватым оттенком кристаллический порошок, без запаха, легко окисляется под действием света и кислорода воздуха.
Растворимость:
Легко растворим в воде, мало в спирте, практически не растворим в эфире и хлороформе.
Подлинность:
- С FeCL3 образуется зелено-изумрудное окрашивание, при добавлении NH4OH образуется вишнево-красное, затем оранжево-красное окрашивание.
- 1 мл 0,2 % раствора препарата + 5 мл гидротартратного буферного раствора + раствор йода , 5минут стоит + тиосульфат натрия , раствор сохраняет темно-красное окрашивание.( При гидротартратном буферном растворе с ph 3,5-темно-красный цвет, при тартратном буферном растворе с ph 6,5 – красно-фиолетовое окрашивание.)




- 2 г. препарата растворяют в 80 мл воды, содержащей 0,4 бисульфита натрия + 5 мл раствора аммиака (до ph 8-9) и оставляют на 1 час в холодном месте (при t не выше
4°С). Выпавший осадок отфильтровывают и промывают водой, спиртом, эфиром,
H2SO4 в течении 3 часов. 1г. полученного основания помещают в мерную колбу,
растворяют в HCL и определяют температуру удельного вращения 48°-54° С
Чисотота:
— Определяют предел кислотности
— Адреналон, норадреналон в пределе эталона.
Количественное определение:
1. Неводное титрование. Гидротартрат адреналина растворяют в ледяной уксусной кислоте и титруют 0,1 N хлорной кислотой (HCLO4) индикатор метиловый фиолетовый до голубого окрашивания.
Фармакопейными препаратами являются:














2 .Раствор адреналина гидротартрата 0,18 % — для инъекций.
Состав: Адреналина гидротартрата 1,82
Натрия метабисульфита 1,0
Натрия хлорида 8,0
Воды для инъекций до 1 л
Срок годности 1 год.
Раствор фильтруют, разливают в ампулы нейтрального стекла по 1 мл. Стерилизуют текучим паром при температуре 100° С –15 минут.
3. Раствор адреналина гидрохлорида- Sol. Adrenalini hydrohcloridi 0,1 %
Состав: Адреналина 1,0
Натрия хлорида 8,0
Натрия метабисульфита 1,0
HCL 0,01 N до 1 л
Разливают в асептических условиях в ампулы по 1 мл или во флаконы по 10 мл нейтрального оранжевого стекла.
Применение:
Для повышения артериального давления, оказывает сосудосуживающее действие, местно применяется для остановки кровотечений, иногда смачивают раствором тампон. 1-2% раствор для лечения простой открытоугольной формы глаукомы. Назначают адреналин подкожно, внутримышечно и местно. В случае сердечной остановки вводят адреналин внутрисердечно. Внутрь не назначают. Применяют при анафилактическом шоке, аллергическом отеке гортани, при бронхиальной астме, аллергических ринитах, при гипергликемической коме.
Препарат нестоек, разлагается под воздействием кислорода воздуха, света.
Хранение:
ВРД 1 мл ( подкожно)
ВСД 5 мл ( подкожно)
Приложение:
Димедрол
К 1 мл исследуемого раствора прибавляют 3 мл хлороформа и титруют 0,02 моль/л раствором гидроксида натрия при взбалтывании до розового окрашивания водного слоя (индикатор – фенолфталеин).
1 мл 0,02 моль/л раствора натрия гидроксида соответствует 0,005836 димедрола.
Масса димедрола 0,05
Пределы по массе 0.0425 –0,0575
АРОМАТИЧЕСКИЕ КИСЛОТЫ.
КИСЛОТА БЕНЗОЙНАЯ.
ACIDUM BENZOICUM.

 |
Бензойная кислота получила свое название от бензойной смолы, из которой она была впервые выделена в 1608г. Содержится в смоле до 80%. В1775г фармацевт Шееле получил эту кислоту, обрабатывая смолу щелочами. Небольшое количество ароматических кислот содержится в ягодах, плодах, коре некоторых растений, а также в смолах, камедях, бальзамах.
Получают синтетически.
Современный способ получения основан на окислении толуола различными окислителями: азотная кислота, хромовая кислота, диоксид марганца.




2. Окисление кислородом воздуха в жидкой фазе.
 |  |
Описание:
Бесцветные игольчатые кристаллы или белый мелкокристаллический порошок. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, хлороформе, эфире и бензоле. Растворим в жирных маслах.
При нагревании возгоняется. Перегоняется с водяным паром.
Подлинность:






 |
2) t о плав. 122 –124,5 о С.
Чистота:
Проверяют наличие примесей восстанавливающих веществ, фталевой кислоты.
Хлориды, сульфаты , тяжелые металлы в пределе ГФ Х.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
OH ONa
Хранение:
В хорошо укупоренной таре т. к. бензойная кислота возгоняется.
Применение:
НАТРИЯ БЕНЗОАТ.
NATRII BENZOAS.
 |
Получение:
При нейтрализации бензойной кислоты раствором карбоната натрия.
 |
 |
 |

Описание:
Белый кристаллический или аморфный порошок без запаха или с очень слабым запахом. Легко растворим в воде, умеренно растворим в спирте 90 о . Практически нерастворим в эфире и хлороформе.
Подлинность:
- Бензоат – ион см. бензойную кислоту.
- Определяют ультрафиолетовый спектр препарата.
- Na + — окрашивает пламя в желтый цвет.
- Препарат растворяют в воде, прибавляют азотную кислоту, выделившиеся белые кристаллы отфильтровывают, промывают водой и высушивают до постоянного веса, определяют температуру плавления (ГФ Х).
Чистота:
— Водный р-р препарата должен быть бесцветным и прозрачным.
— Щелочность или кислотность.
— Хлориды, сульфаты, тяжелые металлы в пределе эталона.
— Потеря в весе не более 2%.
— Определяют микробиологическую чистоту.
Количественное определение:
КИСЛОТА САЛИЦИЛОВАЯ.
ACIDUM SALICYLICUM.
 |
2 – гидроксибензойная кислота
OH о- оксибензойная кислота
Салициловая кислота была открыта в 1838г. Встречается в виде своих производных в ряде растений.
Салициловую кислоту можно получить из гликозида салицина, содержащегося в коре ивы. Практического значения этот способ не имеет.
В химической промышленности салициловую кислоту получают путем карбоксилирования фенола по реакции Кольбе – Шми
NaOH CO2 COONa HCL COOH
Выпаренную досуха смесь фенола с эквивалентным количеством едкого натра нагревают в автоклавах (130 о С) с углекислотой под давлением 4,5 – 5 атмосфер. Продукт реакции растворяют в воде, подкисляют хлороводородной кислотой и выделившуюся салициловую кислоту перекристаллизовывают
Механизм реакции заключается во внедрении углекислоты в бензольное ядро в орто и пара положения, активированные наличием фенолята.
Описание:
Белые, мелкие, игольчатые кристаллы или кристаллический порошок без запаха. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно в хлороформе. Летуч с водяным паром. При нагревании возгоняется.
Подлинность.
- С р-ром хлорида окисного железа образуется сине-фиолетовое окрашивание, которое исчезает от прибавления нескольких капель хлороводородной кислоты и сохраняется в присутствии уксусной кислоты. В присутствии хлорида железа происходит реакция по схеме:
 |
 |
- При нагревании 0,1 препарата с 0.3 цитрата натрия, происходит разложение препарата с образованием фенола (запах) и углекислого газа
 |
 |


- При нагревании кислоты салициловой с конц. серной кислотой образуется углекислый газ, при пропускании которого через известковую воду образуется опалесценция.

При действии на препарат раствором формальдегида в присутствии конц. серной кислоты (реактив Марки) образуется окрашенное в красный цвет соединение — ауриновый краситель.
Чистота:
1. Спиртовой р-р препарата должен быть бесцветным и прозрачным.
- Не должно быть красящих веществ, фенола, железа.
- Хлориды, сульфаты, тяжелые металлы и органические примеси в пределе
Количественное определение.
Метод кислотно – основное титрование.
Точную навеску препарата растворяют в нейтрализованном по ф/ф спирте и титруют 0,1 н р-ром натрия гидроксида до розового окрашивания.
 |
 |

Э=Mr
Хранение:
В хорошо укупоренной таре, предохраняющей от действия света.
Применение:
Антисептическое средство и кератолитическое.
Лек. формы: спиртовой р-р 2-5%, присыпки, мази и пасты 1-10%.
НАТРИЯ САЛИЦИЛАТ.
NATRII SALICYLAS.
 |
Получение:
При нейтрализации р-ра салициловой кислоты эквивалентным количеством карбоната натрия или гидрокарбоната натрия.
 |
 |


ОН OH
Соль перекристаллизовывают из спирта.
Описание:
Белый кристаллический порошок или мелкие чешуйки без запаха. Очень легко растворим в воде, легко в глицерине, растворим в спирте, практически не растворим в эфире.
Подлинность:
- Препарат растворяют в воде. Полученный р-р дает характерные реакции на салицилаты с хлоридом железа (III), образуется сине – фиолетовое окрашивание.
- Препарат растворяют в воде, прибавляют разб. азотную кислоту. Осадок отфильтровывают, промывают водой, высушивают. Определяют t o плавления салициловой кислоты. (156-161 о С).
- На натрий – окрашивание пламени в желтый цвет.
- Определяют инфракрасный спектр препарата.
Чистота:
- Определяют прозрачность и цветность р-ра. (растворяют в воде).
- Хлориды, сульфаты, тяжелые металлы, органические примеси в пределе эталона.
- Потеря в массе при высушивании не более 0,5 %.
- Определяется микробиологическая чистота.
Количественное определение.
КИСЛОТА АЦЕТИЛСАЛИЦИЛОВАЯ
ACIDUM ACETYLSALICYLICUM.
ASPIRINUM.
 |
Салициловый эфир уксусной кислоты
Получение:


СООН безвод. ZnCL2 COOH

ОН ацетилхлорид O-C-CH3
2. Промышленный способ получения основан на нагревании (50-60 о С) смеси салициловой кислоты и уксусного ангидрида.



О О
Описание:
Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом, слабокислого вкуса. Малорастворим в воде, легко растворим в спирте, хлороформе, эфире, растворах едких щелочей и углекислоте.
Ацетилсалициловая кислота не совместима с веществами основного характера, а также двууглекислыми щелочами — дает легко отсыревающие смеси.
Подлинность:
1. Проводят омыление препарата при кипячении его с раствором едкого натра
в течение 3 минут, охлаждают и подкисляют разв. серной кислотой –
выпадает белый кристаллический осадок салициловой кислоты, р-р
приобретает запах уксусной кислоты.
 |  |



О
 |
 |


Р-р сливают в другую пробирку, прибавляют равные объемы спирта и конц. серной кислоты, появляется запах уксусно-этилового эфира. К осадку прибавляют 1-2 кап. р-ра хлорида железа(III), появляется характерное фиолетовое окрашивание.
2. Несколько кристаллов препарата помещают в фарфоровую чашку,
прибавляют несколько капель конц. серной кислоты, перемешивают и
добавляют 1-2 капли воды, ощущается запах уксусной кислоты, + 1-2 капли
формалина появляется розовое окрашивание.
3. t о плав. 133 о -138 о С.
Чистота:
салициловой кислоты не более 0,05%;
хлориды, сульфаты, тяжелые металлы, органические кислоты в пределе эталона;
сульфатной золы не более 0,1 %.
Количественное определение:
Алкалиметрия
Метод основан на кислых свойствах препарата.
Точную навеску препарата растворяют в спирте нейтрализованном по ф/ф и титруют 0,1 н р-ром натрия гидроксида до розового окрашивания, индикатор ф/ф.
 |  |

 |  |
 | |
 |
Хранение:
В сухом месте, в хорошо укупоренной таре.
Применение:
Противоревматическое, противовоспалительное, болеутоляющее, жаропонижающее средство.
Вопросы для закрепления:
ЛЕКЦИЯ №18
ТЕМА: «КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ АМИНОСПИРТОВ, АРОМАТИЧЕСКИХ КИСЛОТ И ФЕНОЛОКИСЛОТ»
ПЛАН:
Общая характеристика групп.
Источник