Ингаляционный способ введения лекарственных средств относится
Это метод введения лекарственных веществ, через дыхательные пути. Ингаляционно можно вводить в организм лекарства как местного, так и системного действия.
Данным способом в организм вводятся газообразные и летучие вещества, жидкостные аэрозоли и порошки определенного размера частиц. Ингаляционное введение уменьшает время всасывания, обеспечивает избирательное действие введенного вещества на дыхательную систему, позволяет получать как местный, так и резорбтивный эффект (действие лекарственных средств после их всасывания в кровь).
- ОРВИ (ринит, фарингит, ларингит, трахеит) и их осложнения (риносинусит, ларинготрахеит).
- Обострение хронического ринита, хронического синусита, хронического тонзиллита.
- Бронхиальная астма.
- Пневмонии в период разрешения.
- Острый и обострение хронического бронхита.
- Бронхоэктатическая болезнь лёгких.
- Грибковые поражения верхних и нижних дыхательных путей.
- Туберкулёз лёгких и бронхов.
- Муковисцидоз.
- Для профилактики послеоперационных осложнений.
- ВИЧ – инфекция (стадия респираторных расстройств).
Противопоказания для выполнения:
- Легочные кровотечения
- Травматический или спонтанный пневмоторакс.
- Буллёзная эмфизема лёгких.
- Сердечная аритмия.
- Тяжёлая сердечная недостаточность.
- Индивидуальная непереносимость назначенных препаратов (аллергия).
Источник
ПУТИ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗМ ЧЕЛОВЕКА
Часть 2. Парентеральный путь введения ЛС
К парентеральным путям введения относятся инъекционные пути в сосудистое русло (артерию, вену), под кожу, в мышцу и т.п., а также вводимые в различные полости организма, вдыхаемые ингаляционно или наносимые на кожу.
Преферанская Нина Германовна
Доцент кафедры фармакологии фармфакультета Первого МГМУ им. И.М. Сеченова, к.фарм.н.
Инъекционный способ введения обеспечивает быстроту действия, максимальную биодоступность ЛВ и не зависит от состояния больного. Наиболее часто его используют в стационарных условиях. Лекарства вводят с помощью шприцев, одноразовых систем для инфузий, специализированных шприц-ампул, шприц-тюбиков или с помощью безыгольных инъекторов. Инъекции могут быть: подкожные (п/к), внутримышечные (в/м), внутривенные (в/в), внутриартериальные (в/а), спинномозговые, эндолюмбальные и др. Самым быстрым по скорости наступления эффекта является внутривенный способ введения. Поэтому его часто используют в практике неотложных состояний, в случаях, когда невозможно ввести лекарство другим способом. Внутривенно можно вводить только стерильные, прозрачные растворы. В некоторых случаях допускается небольшое содержание спирта или пропиленгликоля. Недопустимо введение в вену масляных растворов, взвесей и растворов с пузырьками воздуха. Иногда прибегают к длительному внутривенному введению ЛС малыми порциями капельно, инстилляционно (от лат. instillatio – вкапывание), что обеспечивает постоянную его концентрацию в крови. Основным средством доставки ЛВ к органам и тканям, пораженным патологическим процессом, является кровь. Поэтому в последнее время распространение получило внутриартериальное введение ЛС. Таким путем вводят некоторые противомикробные и противоопухолевые средства, т.к. лекарство попадает непосредственно в артерию, кровоснабжающую данный орган.
Значительно чаще применяются подкожный и внутримышечный способы введения ЛС, которые обеспечивают сравнительно точную дозировку и быстрое поступление лекарственного вещества в общий кровоток. В подкожную жировую клетчатку вводят обычно водные или масляные растворы, а внутримышечно можно вводить растворы и взвеси. Подкожно и внутримышечно не рекомендуется вводить лекарство, вызывающее некроз или раздражение тканей. Следует отметить, что мышечная ткань менее чувствительна к раздражающим агентам, чем подкожная клетчатка. Внутримышечно иногда вводят взвеси труднорастворимых и медленно рассасывающихся действующих веществ с целью обеспечения длительного (пролонгированного) действия. Например, Бициллин-3 (комбинированный препарат солей бензилпенициллина) после внутримышечного введения рассасывается в течение 1 или 4 нед.
Больной, как правило, не в состоянии самостоятельно сделать себе инъекцию, и поэтому введение лекарств инъекционным способом требует специально обученного медицинского персонала. При неквалифицированном парентеральном введении могут возникать различные осложнения: тромбоз вен, эмболия, гематомы, некроз тканей, болевой синдром. Возможен перенос инфекции в группах риска (у больных сифилисом, ВИЧ-инфекцией, гепатитом и др.) и при нарушении герметичности упаковки одноразового шприца.
Иногда ЛС вводится непосредственно в определенную полость, где развиваются патологический процесс или патологические очаги в тканях (полости брюшины, плевры, гайморовых полостях, мочевом пузыре, матке, суставе, спинномозговом канале и т.п.). Такой путь введения называется внутриполостной, к нему относятся: конъюнктивальное, интраназальное, внутриплевральное, внутривагинальное, интрастернальное, интратрахеальное, интравентрикулярное, внутриплевральное, интратекальное и др. пути введения. Однако методы введения лекарства здесь могут быть самыми разнообразными (в т.ч. инъекционные), как и применение лекарственных форм от инъекций до введения капель в ухо, нос или глаза, а также мазей для носа, глазных пленок и др. В наружный слуховой проход (в ухо) лекарство могут вводить с помощью турундочек, увлажняя их раствором лекарства, или при нанесении крема, мази, геля. В акушерско-гинекологической практике используют специальные методы введения лекарства, например, внутриматочное введение контрацептива «Мирена», эндоцервикальное введение (введение в цервикальный канал ниже уровня внутреннего зева), интраамниальное введение (в плодный пузырь), интравагинально, например, вводят крем, суппозитории «Овестин». Интравитреальную инъекцию применяют в глазной практике, когда препарат «Луцентис» необходимо ввести в стекловидное тело. К внутриполостным путям введения относят также внутрибрюшинное и внутрикостное введение, эти же пути введения можно отнести к инъекционным, т.к. лекарство вводят с помощью шприца. Инъекционный метод (введение с помощью шприца с иголкой) используют и для введения местных анестетиков. Обильное послойное пропитывание тканей раствором анестетика применяется для инфильтрационной анестезии (инфильтрационное введение). Введение анестетика вокруг нервных стволов вызывает проводниковую (стволовую, регионарную) анестезию. При спинномозговой анестезии раствор анестетика вводят в спинномозговую жидкость в поясничном отделе позвоночника. В зависимости от пространства и локализации действия местного анестетика различают субарахноидальное, эпидуральное, каудальное и паравертебральное введение.
Очень важным является ингаляционный способ введения лекарств (лат. inhalare – вдыхать). Этим путем можно вводить газы, пары летучих веществ, аэрозоли, мелкодисперсные порошки. Стенки легочных альвеол имеют очень густую сеть кровеносных капилляров и в своей совокупности представляют большую поверхность (
90 м2), поэтому всасывание действующих веществ через легкие происходит очень быстро. При ингаляционном введении лекарственных средств нужно помнить, что только газы, пары и аэрозоли с мелкими частицами доходят свободно до альвеол. Крупные частицы аэрозоля оседают в трахее и бронхах на пути к альвеолам. Ингаляционный способ введения позволяет создать высокую концентрацию лекарственного вещества на месте введения, что наиболее удобно для лечения бронхолегочных заболеваний и купирования приступов, например, при бронхиальной астме. Особое значение имеет размер частичек действующего вещества, степень дисперсности (лат. disperses – рассыпанный, степень раздробленности вещества на частицы). Частицы размером 20 мкм проникают в терминальные бронхиолы, размером 6 мкм – в респираторные бронхиолы, 2 мкм – в предальвеолярный жом и менее 1 мкм – в альвеолы. Очень сильно измельченное ЛВ, проникая в альвеолы, может повредить структуру мембраны и нарушить дыхательную функцию. Для ингаляционного введения применяются специальные системы доставки: ингалятор для введения сухого порошкообразного вещества, аэрозольный ингалятор дозированный, турбухалеры, различной конструкции небулайзеры, спейсеры и т.п. Преимуществом ингаляционного способа введения является легкость регулирования поступления определенной концентрации вещества в кровь и управляемость этим процессом. Ингаляционным способом вводят и некоторые общие анестетики (средства ингаляционного наркоза), которые через специальные наркозные аппараты создает и поддерживает во вдыхаемом воздухе необходимую концентрацию наркотического вещества. Современные средства для наркоза (общего обезболивания) вводят вместе с кислородной смесью, наркоз хорошо управляем и препараты обладают высокой скоростью выхода больного из наркоза.
ЛС можно вводить трансдермально (гр. derma – кожа) через кожу. Накожно наносят путем втирания в кожу специальных мазей, линиментов, паст или путем прикрепления пластырей. Иногда ионизированные ЛВ вводят с помощью электрофореза или ионофореза, прохождение которых через кожу происходит под воздействием слабого электрического поля. В некоторых случаях лекарства имплантируют в таблетках под кожу через разрез в ней. Лекарственные препараты в таких случаях рассасываются очень медленно, в течение 3–5 месяцев, а иногда эти сроки увеличиваются на несколько лет. Таким путем вводят, например, гормональные препараты при недостатке в организме гормонов или с целью контрацепции, а также средства для лечения алкоголизма и наркомании. В последнее время широкое распространение получили трансдермальные терапевтические системы (ТТС). С их помощью удается длительно поддерживать постоянную концентрацию действующего вещества в плазме крови. Например, к таким лекарственным средствам относят Депонит, Нитро-дур, Дюрогезик, Никотинелл, Транстек и др.
Все пути введения имеют определенные преимущества и недостатки, знание которых позволяет при различной патологии выбрать правильный путь введения лекарства для достижения необходимого терапевтического эффекта.
Источник
Устройства доставки ингаляционных препаратов, используемые при терапии заболеваний дыхательных путей
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
НИИ пульмонологии МЗ РФ, Москва
НИИ пульмонологии МЗ РФ, Москва
П ри заболеваниях дыхательных путей (бронхиальная астма, хроническая обструктивная болезнь легких и др.) основной способ введения лекарственных препаратов – ингаляция медицинских аэрозолей ( b 2–агонисты, антихолинергические препараты, глюкокортикостероиды, кромоны). Ингаляционные устройства представляются наиболее логичными и эффективными, так как лекарственный препарат непосредственно направляется к тому месту, где он должен действовать – в дыхательные пути. Можно выделить следующие преимущества ингаляционного способа введения лекарств: более быстрое начало действия лекарственного средства, требуется меньшая доза препарата, снижается риск развития побочных эффектов.
Любая ингаляционная техника предназначена для доставки лекарственного препарата в дыхательные пути. Одним из главных параметров эффективности ингаляционного устройства является такая величина, как депозиция (т.е. отложение) препарата в дыхательных путях. Легочная депозиция препаратов при использовании различных систем доставки колеблется в пределах от 4 до 60% от отмеренной дозы.
Основные механизмы депозиции – инерционное столкновение, седиментация (оседание) и диффузия (Swift, 1985). Депозиция аэрозоля путем инерционного столкновения происходит, когда инерция частицы не в состоянии обеспечить ее дальнейшее движение с потоком воздуха при изменении направления потока. Такой механизм имеет место в верхних дыхательных путях, в глотке, гортани и в местах бифуркации дыхательных путей. Седиментация (оседание) ответственна за депозицию частиц аэрозоля, не подвергнувшихся столкновению при вхождении в легкие. Седиментация увеличивается при задержке дыхания и при медленном, спокойном дыхании. Броуновская диффузия является важнейшим механизмом, ответственным за депозицию в легких частиц размерами менее 0,5 мкм. Такая депозиция имеет место в дистальных, газообменных отделах легких и составляет очень малую долю общей легочной депозиции терапевтического аэрозоля.
Основным фактором, определяющим депозицию частиц в дыхательных путях, является размер частиц аэрозоля. В аэрозольной медицине принято использовать следующие понятия:
- Срединный массовый аэродинамический диаметр частиц (mass median aerodynamic diameter: MMАD) – определяется тем, что половина массы аэрозоля содержится в частицах большего диаметра, а другая половина – в частицах меньшего диаметра.
- Респирабельные частицы – частицы с аэродинамическим диаметром Дозированные аэрозольные ингаляторы
Дозированные аэрозольные ингаляторы (ДАИ) являются наиболее известными и распространенными в мире системами доставки лекарственных аэрозолей. Первый ДАИ Medihaler™ был изготовлен в 1956 г., сначала в стеклянном, а с 1963 г. – в алюминиевом корпусе (Huchon, 1997).
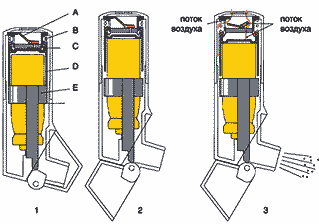
В классическом ДАИ под давлением содержатся микронизированный препарат в виде суспензии и пропеллент фреон (Ф), представляющий собой хлорфторуглерод (chlorofluorocarbon – CFC). Кроме того, для смазывания клапана и сохранения лекарственного вещества в виде суспензии в состав ДАИ входит также и сурфактант (рис. 1). Обычно лишь около 30–40% всех частиц аэрозоля, генерируемого ДАИ, находятся в пределах респирабельных размеров (менее 5 мкм).
Рис. 1. Генерация аэрозоля с помощью ДИ. А — канистра, В — клапан, С — мундштук
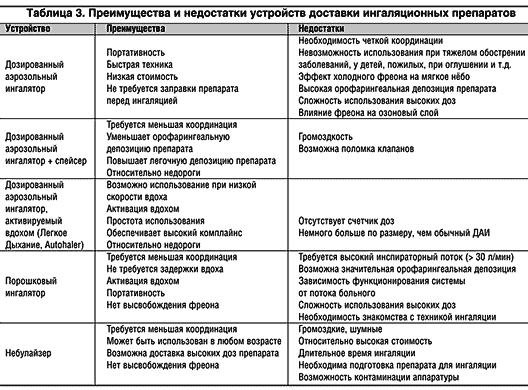
Достоинствами ДАИ является их удобство, портативность, быстрота выполнения процедуры, низкая стоимость. Высвобождаемая из ДАИ доза препарата хорошо воспроизводима. Однако несмотря на относительную простоту, ДАИ имеют серьезные недостатки. Главные проблемы связаны с использованием фреона, который создает высокоскоростное «облако» аэрозоля (скорость более 30 м/с) в течение короткого отрезка времени. Высокая скорость аэрозоля приводит к массивной депозиции препарата на задней стенке глотки (около 80%), в то время как легочная депозиция обычно не превышает 10% от отмеренной дозы; еще около 10% дозы остается в ингаляторе (Newman et al., 1984). Другим недостатком, связанным с фреоном, является его низкая температура (до –30°С), что при его контакте с мягким небом может приводить к рефлекторному прерыванию вдоха – так называемый эффект холодного фреона.
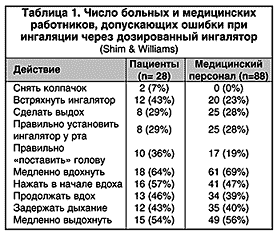
Еще одно последствие высокой скорости аэрозоля – сложность координации вдоха с высвобождением препарата из ингалятора. Неправильно используют ДАИ от 8 до 54% всех больных бронхиальной астмой (БА) (мета–анализ Cochrane et al., 2000). Правильная ингаляционная техника позволяет добиться значительного эффекта при доставке препарата в легкие. У больных с хорошей координацией вдоха и высвобождения аэрозоля легочная депозиция препарата (18,6%) почти втрое больше, чем у пациентов с неадекватной техникой использования ДАИ (7,2%) (Newman et al., 1991). Обучение больных правилам ингаляции значительно снижает остроту проблемы координации, хотя до 20% всех пациентов все же не способны правильно пользоваться ДАИ. Озабоченность вызывает то, что даже медицинский персонал при демонстрации ингаляционной техники допускает порой не меньше ошибок, чем больные (табл. 1).
Оптимальная техника ингаляции – медленный вдох (инспираторный поток около 30 л/мин) с последующей задержкой дыхания до 10 сек (Pedersen, 1996). При этом требуется встряхивать ДАИ перед каждой ингаляцией: лекарственный препарат в резервуаре ингалятора находится в виде суспензии, а по тому необходимо равномерно распределять его перед ингаляцией.
К недостаткам ДАИ относятся также постепенное снижение эффективности препарата по мере его хранения и непредсказуемые колебания его дозы после использования заданного количества доз – «феномен остатка». Данный феномен означает, что после высвобождения номинальных 200 доз препарата в камере ДАИ может оставаться еще до 20 доз, однако содержание в них лекарственного вещества очень сильно варьирует (June, 1997), что негативно влияет на результативность терапии в целом.
Наконец, существенный недостаток классических ДАИ – наличие в них фреонов, участвующих в повреждении озонового слоя атмосферы, что ведет к глобальному потеплению климата («парниковый эффект»).
Для замены фреонов были предложены другие пропелленты – гидрофторалканы (HFA–134a) (June, 1997). В отличие от фреона, HFA не содержит атома хлора, не вызывает разрушения озонового слоя, имеет очень низкую химическую реактоспособность; период сохранения в стратосфере составляет около 15 лет, и к тому же он обладает меньшим (примерно в 6 раз) потенциалом создания «парникового эффекта» (Tashkin, 1998). Новый пропеллент HFA абсолютно не токсичен, имеет очень низкую растворимость в воде и липидах (Leach, 1997). Создание новых ДАИ с пропеллентом HFA привело не просто к замене наполнителя, а к полному изменению технологии ДАИ. В бесфреоновых ДАИ лекарственный препарат содержится не в виде суспензии, а в виде раствора (для его стабилизации используется этанол, олеиновая кислота или цитраты). Новшество сделало ненужным предварительное взбалтывание содержимого ингалятора, однако больной может ощущать появившийся привкус алкоголя.
Достоинством бесфреоновых ДАИ является создание низкоскоростного «облака» аэрозоля, что приводит к значительно меньшей депозиции препарата в ротоглотке и меньшему риску развития эффекта холодного фреона (температура «облака» около 3°С) (Lipworth, 2000). Бесфреоновые ДАИ лишены таких недостатков классических ДАИ, как потеря дозы, «феномен остатка»; они могут функционировать даже при низких температурах окружающей среды (June, 1997).
Создание новых ДАИ с наполнителем HFA позволило также уменьшить и размер частиц аэрозоля. Например, MMAD частиц, образуемых ДАИ с беклометазоном–HFA, значительно меньше, чем у обычного ДАИ с беклометазоном–Ф – 1,1 мкм против 3,5 мкм (Lipworth, 2000). Изменение размера частиц аэрозоля влияет на величину легочной депозиции препарата. Так, при использовании ДАИ беклометазона–HFA депозиция у больных БА достигает 56% по сравнению с 4% при применении ДАИ беклометазона–Ф (Leach, 1998). Очевидно, такое различие требует пересмотра доз ингаляционных глюкокортикостероидов – для обеспечения контроля симптомов БА с помощью ДАИ беклометазона–HFA достаточно дозы в 2,6–3,2 раза меньше обычной (Lipworth, 2000).
ДАИ, активируемые вдохом
ДАИ, активируемые вдохом, были созданы для преодоления проблемы координации вдоха и активации ингалятора. К таким ингаляторам относятся Autohaler (3M Pharmaceutical), Easy–Breath (зарегистрирован в России под названием «Легкое Дыхание», Baker Norton) и Breath–Operated Inhaler (Baker Norton). Их главным отличием является пружинный механизм, который взводится либо открытием колпачка (Легкое Дыхание, рис. 2), либо поднятием специального рычажка (Autohaler). В ответ на вдох (средний инспираторный поток 20 и 30 л/мин) в течение 0,2 с происходит высвобождение дозы препарата. Легочная депозиция препаратов достигает значений в 2 раза больших по сравнению с обычными ДАИ (18–21%) (Newman, 1991).
Рис. 2. Устройство ДАИ А — клапан, В — пружина, С — диафрагма, D — пусковое устройство, E — держатель баллончика
Клинические исследования показали, что больные очень быстро обучаются ингаляционной технике с использованием ДАИ, активируемых вдохом (Crompton & Duncan, 1989). В исследовании Lenney et al. (2000) хорошая техника ингаляции с помощью ДАИ «Легкое Дыхание» и Autohaler была продемонстрирована у 91% больных. Кроме того, активируемые вдохом ДАИ являются устройствами, которым больные чаще всего отдают предпочтение по сравнению со всеми другими системами для ингаляций.
Комбинация ДАИ со спейсерами
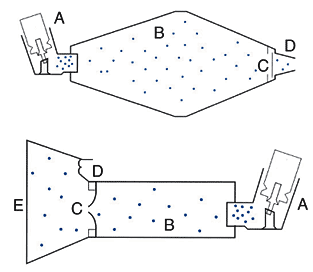
Спейсер представляет собой объемную камеру, которая соединяет дозированный ингалятор и дыхательные пути больного. Спейсеры позволяют решать проблемы координации вдоха пациента и высвобождения лекарственного препарата, а также уменьшить орофарингеальную депозицию препарата и связанные с ней местные побочные эффекты. Выполняя роль аэрозольного резервуара, спейсеры замедляют скорость струи аэрозоля и увеличивают время и дистанцию пути аэрозоля от ДАИ до рта пациента, в результате чего в дыхательные пути больного проникают частицы малого размера, а более крупные оседают на стенках камеры (рис. 3).
Рис. 3. Схема спейсеров. А — ДИ, В — камера спейсера, С — однонаправленный клапан, D — загубник (сверху), Е — маска
Спейсеры снижают риск эффекта «холодного фреона» и преждевременного прекращения вдоха. Техника использования спейсеров намного проще по сравнению с ДАИ, что делает возможным их применение у пациентов практически всех возрастных категорий, включая и детей.
Оптимальной техникой ингаляции аэрозоля через спейсер является глубокий медленный вдох (инспираторный поток около 30 л/мин) или два спокойных глубоких вдоха (до 4–5 вдохов для детей) после высвобождения одной дозы в камеру небулайзера, или даже обычное спокойное дыхание – для детей. Достоинством спейсера является возможность отсрочки выполнения ингаляции после высвобождения препарата до нескольких секунд без снижения клинического эффекта аэрозольной терапии. Однако очень длительная пауза (более 5–10 секунд) снижает количество респирабельных частиц, поэтому следует стремиться к максимально быстрому выполнению вдоха после активации ингалятора, особенно при использовании спейсеров малого объема. Необходимо также помнить: ингаляция аэрозоля из спейсера должна производиться после каждого высвобождения препарата в камеру спейсера (одна доза – один вдох).
Все спейсеры значительно снижают орофарингеальную депозицию лекарственных препаратов – до 17% (Newman SP et al., 1984), что ведет к уменьшению местных побочных эффектов при использовании глюкокортикостероидов (кандидоз и дисфония) и системных эффектов при применении b 2–агонистов вследствие уменьшения абсорбции препарата со слизистых желудочно–кишечного тракта.
Спейсеры приводят к значительному увеличению депозиции препарата в легких по сравнению с ДАИ (в 2–4 раза). По данным исследований с использованием радиоактивной метки, легочная депозиция препаратов при ингаляции через систему спейсер–ДАИ составляла 21–45% (Newman SP et al., 1984; Pierart et al., 1999).
Объем спейсера является важной характеристикой. Считается, что спейсеры большого объема (750 мл: Volumatic, Nebuhaler) более эффективны по сравнению со спейсерами меньших объемов. Однако Agerhort и Pedersen (1994) показали сходную клиническую эффективность ингаляционного будесонида при сравнении ингаляций через Babyspacer (200 мл, 23 см) и Nebuhaler (750 см, 23 см), а в исследовании Bisgaard et al. (1995) поликарбоновые спейсеры по степени эффективности были расположены в следующем порядке: Babyhaler (350 мл, 23 см), Nebuhaler и Aerochamber (145 мл, 11 см). Эти данные говорят в пользу того, что эффективность спейсера определяется не столько объемом, сколько его длиной.
Металлические спейсеры (Nebuchamber), по сравнению с пластиковыми (поликарбоновыми) системами, обладают антистатическими свойствами, т.е. не имеют электростатического заряда на своей поверхности и не вызывают повышенного осаждения частиц аэрозоля (Barry & O’Callaghan, 1999). Электростатический заряд является значимым фактором, влияющим на выход аэрозоля при использовании пластиковых спейсеров. Для решения данной проблемы предлагается создание антистатического покрытия на поверхности спейсера, что может быть достигнуто либо «примированием» устройства лекарственным препаратом, либо обработкой спейсера ионными детергентами. «Примирование» нового или вымытого спейсера создается впрыскиванием в него нескольких доз из ДАИ (обычно около 15 доз), вследствие чего образуется тонкий антистатический слой (Pedersen, 1996). Обработка спейсера ионными детергентами является очень эффективным методом: она обеспечивает повышение легочной депозиции препаратов от 11,5 до 45,6% – в 4 раза (Pierart et al., 1999).
Оборудование спейсеров лицевыми масками позволяет использовать данный тип доставки аэрозоля у детей до 3 лет (O’Callaghan & Barry, 1995).
Основным недостатком спейсеров является их относительная громоздкость, что затрудняет их использование больными вне дома.
Первым порошковым ингалятором (ПИ) явился ингалятор Spinhaler, созданный для доставки в легкие высоких доз кромогликата натрия (Bell et al., 1971). Новый тип ингалятора сразу привлек к себе внимание, так как в основу работы устройства был положен принцип высвобождения лекарственного препарата в ответ на инспираторное усилие больного (активация вдохом). Тем самым решалась проблема координации.
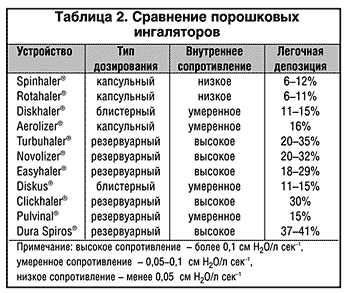
ПИ используют лекарственное вещество в сухом виде (порошок), которое при помощи энергии вдоха пациента доставляется в его дыхательные пути. В ПИ препарат находится в виде больших агрегатов (около 60 мкм) либо в чистом виде – Turbuhaler (AstraZeneca), либо, в большинстве случаев, в соединении с носителем – лактозой или бензоатом натрия – Циклохалер (Пульмомед). Во время вдоха больного в ингаляторе создаются турбулентные потоки и часть лекарственного вещества, проходя через устройство, «разбивается» до частиц респирабельных размеров. Эти респирабельные частицы сухого вещества аэродинамически более стабильны, нежели частицы ДАИ, так как транспортируются в легкие со скоростью потока воздуха, а не со скоростью струи пропеллента, не меняют своего размера и формы после высвобождения из устройства, а по тому обеспечивают большую депозицию препарата в легких – до 40% (табл. 2). Частицы, которые не подверглись микронизации, в т.ч. и с носителем, оседают в ротоглотке, причем для ПИ орофарингеальная депозиция по–прежнему остается довольно значимой проблемой (50–80%) (Pedersen, 1996).
Достоинствами ПИ являются (как и у ДАИ) их портативность, компактность, удобство и относительная простота использования (не у всех моделей!). В отличие от ДАИ порошковые ингаляторы не используют фреоны. Нельзя не отметить, что переход на бесфреоновые формы ингаляционных устройств в течение последнего десятилетия значительно стимулировал появление новых моделей ПИ.
Зависимость функционирования ПИ от инспираторного потока больного может быть не только достоинством (хорошая координация), но и недостатком, поскольку доставка препарата в дыхательные пути может находиться в прямой связи с величиной инспираторного потока. Некоторые ПИ для преодоления сопротивления ингалятора требуют относительно высокого инспираторного потока (60 л/мин), что иногда становится проблемой при их использовании у детей и в случаях тяжелого бронхоспазма. Например, Newman et al. (1991) показали, что при использовании Turbuhaler (AstraZeneca) легочная депозиция тербуталина составляла 35% при инспираторном потоке 60 л/мин и 8,9% – при потоке 15 л/мин. Другой проблемой ПИ, связанной с инспираторным усилием больного, является более высокая вариабельность высвобождаемой дозы препарата по сравнению с ДАИ. Ингалятор Aerolizer (Novartis), ранее называвшийся Ciclohaler, имеет умеренное сопротивление, что позволяет применять его при более низких инспираторных потоках (30 л/мин) (Chew et al., 2001). Однако эффективность Aerolizer также зависит от величины потока. В исследовании in vitro показано снижение фракции респирабельных частиц с уменьшением инспираторного потока: MMAD аэрозольных частиц составлял 7,2 и 5,3 мкм при потоках 40 л/мин и 80 л/мин, соответственно (Zanen et al., 1992).
Новые ПИ, такие как HandiНaler (Boehringer Ingelheim) и Clickhaler (ML Laboratories PLC), не меняют свой профиль функционирования и при таких низких потоках, как 15–30 л/мин (Chodosh et al., 2001; Newhouse et al., 1999).
Эффективность работы практически всех ПИ зависит от инспираторного потока. В свою очередь, инспираторный поток через ингаляционную систему зависит от двух факторов – внутреннего сопротивления устройства и инспираторного усилия пациента. По уровню внутреннего сопротивления потоку ПИ можно расположить в следующем порядке: Inhaler M (Boehringer Ingelheim) > Easyhaler (Orion) > Turbuhaler (AstraZeneca) > Novolizer (Sofotec) > Diskus (GlaxoSmithKline) > Aerolizer (Novartis) > Diskhaler (GlaxoSmithKline) > Rotahaler (GlaxoSmithKline) (Fyrnys et al., 2001). Низкое сопротивление устройства, безусловно, дает возможность достичь высокого инспираторного потока при менее интенсивном усилии больного и позволяет использовать ПИ с низким сопротивлением даже при тяжелом бронхоспазме.
С другой стороны, при ингаляции через ПИ с низким сопротивлением инспираторный поток может достичь очень высоких значений, вследствие чего депозиция респирабельных частиц в ротоглотке значительно увеличивается, а в периферических дыхательных путях – снижается. Поэтому, например, оптимальные значения легочной депозиции достигаются при использовании ПИ с высокими-средними внутренними сопротивлениями потоку: Turbuhaler (20–35%), Novolizer (20–32%), Easyhaler (18– 29%), а худшие показатели – при использовании ПИ с низкими сопротивлениями: Rotahaler (6–11%), Spinhaler (6–12%), Diskhaler (11–15%).
При использовании ПИ больным рекомендовано вдыхать через устройство с максимальным усилием – такой прием позволяет обеспечить максимальный инспираторный поток, что ведет к повышению респирабельной фракции аэрозоля. Однако, с другой стороны, очень быстрая ингаляция снижает депозицию в периферических отделах бронхиального дерева, что особенно актуально для ПИ с низким сопротивлением. Задержка дыхания после ингаляции, наклон головы и вдох от уровня более низких легочных объемов не влияют на эффективность ПИ (Pedersen, 1996). Необходимо помнить, что при использовании ПИ пациент не должен выдыхать в ингалятор перед ингаляцией, чтобы не «выдуть» дозу из ингалятора.
По типу дозирования лекарственного препарата все ПИ можно разделить на несколько классов (Цой, 1997; Огородова, 1999):
- однодозовые капсульные
- мультидозовые резервуарные
- мультидозовые блистерные.
Самые ранние модели ПИ (Rotahaler и Spinhaler) и более современные (Aerolizer и Handihaler) используют желатиновую капсулу с лекарственным препаратом. Достоинством капсульных моделей ПИ является точность дозирования препарата, компактный размер устройств, защита лекарственной субстанции от влажности, возможность назначения большой дозы препарата (до 20–30 мг) и низкая стоимость ингалятора. К недостаткам можно отнести неудобство, связанное с частой заправкой ингалятора, и технические проблемы: неадекватное вскрытие капсулы, застревание капсулы в камере ингалятора и возможность ингаляции частиц капсулы (Nielsen et al., 1997). Необходимость заправки ПИ перед каждой ингаляцией не становится большой проблемой при ингаляции бронхолитиков пролонгированного действия – формотерола (Foradil Aerolizer) или тиотропиума бромида (Spiriva HandiНaler), когда требуется использование ингалятора не чаще 1–2 раз в сутки, однако это может вызвать достаточные неудобства при использовании ПИ с другими препаратами, требующими ингаляции чаще 3 раз в сутки.
Более удобны с этой точки зрения мультидозовые резервуарные ПИ (Turbuhaler, Easyhaler, Novolizer, Clickhaler, Airmax, Pulvinal, Циклохалер, Twisthaler), которые по концепции дозирования приближаются к ДАИ. Недостатки резервуарных ПИ – вариабельность дозы, ограничение дозы размером резервуара, сложность устройства и более высокая стоимость. Кроме того, проблемой данного класса ПИ является их влагочувствительность. Абсорбция влаги из окружающей среды или во время использования ингалятора пациентом может повлиять на взаимодействие между частицами препарата или носителя, значительно уменьшив образование респирабельного аэрозоля.
Компромиссом между капсульными и резервуарными ПИ являются мультидозовые блистерные ПИ, в которых используется несколько запакованных в блистеры доз, в виде диска (4 и 8 доз) – Diskhaler или полоски (60 доз) – Diskus. Блистерные ингаляторы успешно решают проблему защиты лекарственного вещества от влаги и обеспечивают довольно высокую точность дозирования.
Немаловажный аспект использования ПИ – их простота и удобство. Наиболее сложной системой является Diskhaler, использование которого требует выполнения особого 5–ступенчатого алгоритма. Достаточно просты Easyhaler, Clickhaler и Airmax™, которые по своей форме напоминают ДАИ. Впрочем, и сама процедура ингаляции через них требует таких же навыков, как при использовании ДАИ: встряхивание и нажатие на дно устройства (или просто открывание мундштука – при использовании Airmax) с последующим вдохом. Такой фактор, как наличие цифрового счетчика доз (Turbuhaler, Easyhaler, Clickhaler, Novolizer, Diskus), также значительно облегчает использование ПИ и улучшает комплайнс к ингаляционной терапии.
Самую длительную историю использования имеют небулайзеры – они применяются уже почти 150 лет. Слово «небулайзер» происходит от латинского «nebula» (туман, облачко), впервые было употреблено в 1874 г. для обозначения «инструмента, превращающего жидкое вещество в аэрозоль для медицинских целей» (Muers, 1997). Один из первых портативных «аэрозольных аппаратов» был создан J.Sales–Girons в Париже в 1859 г. Небулайзеры тогда использовали в качестве источника энергии струю пара, и применялись они для ингаляции паров смол и антисептиков у больных туберкулезом.
В настоящее время в зависимости от вида энергии, превращающей жидкость в аэрозоль, различают два основных типа небулайзеров: 1) струйные или компрессорные, пневматические – использующие струю газа (воздух или кислород); 2) ультразвуковые – использующие энергию колебаний пьезокристалла.
Продукция аэрозоля в ультразвуковом небулайзере практически бесшумная и более быстрая по сравнению со струйными. К числу недостатков относятся: неэффективность образования аэрозоля из суспензий и вязких растворов; как правило, больший остаточный объем; повышение температуры лекарственного раствора во время небулизации и вероятность разрушения структуры лекарственного препарата (Nikander, 1994).
Преимущества небулайзеров: легкая техника ингаляция (спокойное дыхание), отсутствие потребности в форсированном маневре, возможность использования системы даже при самых тяжелых состояниях (астматический статус), у пожилых и у детей, при двигательных расстройствах, при нарушениях уровня сознания.
Достоинством небулайзеров является возможность доставки большой дозы препарата (в случае необходимости во время ингаляции допускается использование кислорода).
Задачей ингаляционной терапии при помощи небулайзера является продукция аэрозоля с высокой пропорцией (> 50%) респирабельных частиц (менее 5 мкм) в течение довольно короткого временного интервала, обычно не более 10–15 минут (Muers, 1997).
Эффективность продукции аэрозоля, свойства аэрозоля и его доставка в дыхательные пути зависят от типа небулайзера, его конструкционных особенностей, объема наполнения и остаточного объема, величины потока рабочего газа, «старения» небулайзера, сочетания системы компрессор–небулайзер и др. (Авдеев, 2001).
Несмотря на сходный дизайн и конструкцию, небулайзеры разных моделей могут существенно отличаться по своим показателям. В исследовании Loffert et al. (1994) при сравнении 17 типов струйных небулайзеров in vitro было установлено, что различия в выходе аэрозоля достигали 2 раз, в величине респирабельной фракции аэрозоля – 3,5 раз, а в скорости доставки частиц респирабельной фракции препаратов – 9 раз. В другом исследовании при сравнении эффективности доставки аэрозоля (8 небулайзеров) было показано, что средняя депозиция препарата в легких различалась в 5 раз, а средняя орофарингеальная депозиция – в 17 раз (Thomas et al., 1991).
Типы струйных небулайзеров. Различают три основных типа струйных небулайзеров (Knoch & Sommer E. 2000).
Конвекционный (обычный) небулайзер является наиболее распространенным типом систем доставки. Такой небулайзер производит аэрозоль с постоянной скоростью, во время вдоха происходит вовлечение воздуха через Т–трубку и разведение аэрозоля. Аэрозоль поступает в дыхательные пути только во время вдоха, а во время выдоха аэрозоль попадает во внешнюю среду, т.е. происходит потеря большей его части (около 55–70%) (Jackson W.F., 1998). Легочная депозиция препаратов при использовании таких небулайзеров относительно невелика – до 10%.
Небулайзеры, активируемые вдохом (известные также, как небулайзеры Вентури): продуцируют аэрозоль постоянно на протяжении всего дыхательного цикла, однако высвобождение аэрозоля усиливается во время вдоха. Такой эффект достигается благодаря поступлению дополнительного потока воздуха во время вдоха через специальный клапан в область продукции аэрозоля, общий поток увеличивается, что ведет и к увеличению образования аэрозоля. Таким образом, соотношение выхода аэрозоля во время вдоха и выдоха увеличивается (до 70:30), повышается количество вдыхаемого препарата, снижается потеря препарата, а время небулизации сокращается (Jackson W.F, 1998). Небулайзеры Вентури позволяют добиться вдвое большей депозиции препарата в дыхательных путях по сравнению с обычным небулайзером (до 19%) (Devadason SG, 1997).
Небулайзеры, синхронизованные с дыханием (дозиметрические небулайзеры), производят аэрозоль только во время фазы вдоха. Генерация аэрозоля во время вдоха обеспечивается при помощи электронных сенсоров потока либо давления, и теоретически выход аэрозоля во время вдоха достигает 100%. Основным достоинством дозиметрического небулайзера является снижение потери препарата во время выдоха (Nicander, 1997).
Новые виды ингаляционных систем
Ингалятор Respimat (Boehringer Ingelheim) является представителем нового класса ингаляционных систем – жидкостных дозированных ингаляторов (Ganderton, 1999). Устройство имеет съемные картриджи, поворот корпуса взводит пружину. При активации ингалятора раствор проходит через сопло с двумя сходящимися каналами. На выходе из них образуются две жидкостных струи, их столкновение друг с другом формирует медленнодвижущееся «облако» аэрозоля (10 м/с). Устройство имеет компактный дизайн и снабжено цифровым счетчиком доз. Легочная депозиция аэрозоля при использовании достигает 45%, а орофарингеальная депозиция колеблется от 26 до 54% (Dolovich, 1999).
На сегодняшний день практически все рассмотренные выше системы доставки аэрозолей имеют не только достоинства, но и недостатки (табл. 3). Аэрозольные технологии – бурно развивающееся направление медицины. Практически каждый год на мировом рынке появляется несколько новых ингаляционных устройств, приближающих нас к заветной цели – созданию «идеального ингалятора». Идеальный ингалятор характеризуют свойства аэрозольного «облака», удобство устройства для больного и общие фармакологические аспекты (Ganderton, 1999).
Условно требования к идеальному ингалятору можно представить следующим образом.
1. Свойства аэрозольного «облака».
- Генерация аэрозольного «облака» должна быть независимой от инспираторного потока больного.
- Генерация аэрозоля должна быть довольно продолжительной, в среднем время генерации аэрозоля более 1 секунды позволяет решить проблему координации вдоха.
- Аэрозоль должен состоять из частиц менее 5 мкм. Частицы меньших размеров необходимы для доставки препарата в периферические отделы дыхательных путей. Возможность варьировать средний размер частиц аэрозоля и распределение может стать дополнительным преимуществом.
- Скорость аэрозольного «облака» должна быть низкой для снижения орофарингеальной депозиции препарата и обеспечения большей доставки препарата в легкие.
2. Удобство использования ингалятора пациентом.
- Простота использования.
- Размеры, близкие к размерам ДАИ.
- Ингалятор должен содержать большое количество доз (более 50).
- Предпочтительно наличие цифрового счетчика доз.
3. Общие фармакологические аспекты.
- Разумная цена ингаляционного устройства.
- Ингалятор должен создавать одинаковую дозу препарата на протяжении всего срока использования, не быть подверженным контаминации и иметь длительный срок службы.
- Отсутствие пропеллента.
1. Swift DL. Aerosol characteristics and generation. In: Moren F, Dolovich MB, Newhouse MT, et al., eds. Aerosols in medicine; principles, diagnosis and therapy. Elsevier Science (Biomedical Division), New York, 1985; 53–76
2. Task Group on Lung Dynamics. Deposition and retention models for internal dosimetry of the human respiratory flow; tract. Health Physics 1966;12:173–208.
3. Goldberg J, Freund E, Beckers B, Hinzmann R. Improved delivery of fenoterol plus ipratropium bromide using Respimat( compared with conventional metered dose inhaler. Eur Respir J 2001; 17: 225– 232.
4. Huchon G. Metered dose inhalers part and present: advantages and limitations. Eur Respir Rev 1997; 7: 41, 26– 28.
5. Newman SP, Millar AB, Lennard–Jones TR, et al. Improvement of pressurised aerosol deposition with Nebuhaler spacer device. Thorax 1984; 39:935–941
6. Cochrane MG, Bala MV, Downs KE, Mauskopf J, Ben–Joseph RH. Inhaled corticosteroids for asthma therapy. Patient compliance, devices, and inhalation technique. Chest 2000; 117: 542– 550.
7. Newman SP, Weisz AWB, Talaee N, et al. Improvement of drug delivery with a breath actuated pressurised aerosol for patients with poor inhaler technique. Thorax 1991; 46:712–716
8. Pedersen S. Inhalers and nebulizers: which to choose and why. Respi Med 1996; 90: 69– 77.
9. June D. Achieving to change: challenges and successes in the formulation of CFC–free MDIs. Eur Respir Rev 1997; 7, 41: 32– 34.
10. Tashkin DP. New devices for asthma. J Allerg Clin Immunol 1998; 101: S409– S416.
11. Leach CL. Safety asessment of the HFA propellant and the new inhaler. Eur Respir Rev 1997; 7: 41, 35– 36.
12. Lipworth BJ. Targets for inhaled treatment. Respir Med 2000; 94(suppl D): S13– S16.
13. Leach CL. Safety asessment of the HFA propellant and the new inhaler. Improved delivery of inhaled steroids to the large and small airways. Respir.Med. 1998; 92(Suppl.A): 3– 8.
14. Lenney J, Innes JA, Crompton GK. Inappropriate inhaler use: assessment of use and patient preference of seven inhalation devices. EDICI. Respir Med 2000; 94: 496– 500.
15. Crompton G, Duncan J. Clinical assessment of a new breath–actuated inhaler. Practitioner 1989;233:268–9.
16. Newman SP, Millar AB, Lennard–Jones TR, et al. Improvement of pressurised aerosol deposition with Nebuhaler spacer device. Thorax 1984; 39:935–941
17. Pierart F, Wildhaber JH, Vrancken I, Devadason SG, Le Souel PN. Washing plastic spacers in household detergent reduces electrostatic charge and greatly improves delivery. Eur Respir J 1999; 13: 673– 678.
18. Agertoft L, Pedersen S. Influence of spacer device on drug delivery to young children with asthma. Arch Dis Child 1994;71:217–20.
19. Bisgaard H, Anhoj J, Klug B, Berg E. A non–electrostatic spacer for aerosol delivery. Arch Dis Child 1995;73:226–30.
20. Barry PW, O’Callaghan C. The output of budesonide from spacer devices assessed under simulated breathing conditions. J Allergy Clin Immunol 1999; 104: 1205– 1210.
21. Barry PW, O’Callaghan C. The optimum size and shape of spacer devices for inhalational therapy. J Aerosols Med 1995;8:303–5.
22. Bell JH, Hartley PS, Cox JSG. Dry powder aerosols. I. A new powder inhalation device. J Pharm Sci 1971; 78: 176– 180.
23. Newman SP, Moren F, Trofast E, Talaee N, Clarke SW. Terbutaline sulphate Turbuhaler effect of inhaled flow rate on drug deposition and efficacy. Int J Pharmaceutics 1991;74:209–13
24. Chew NY, Chan HK. In vitro aerosol performance and dose uniformity between the Foradile Aerolizer and the Oxis Turbuhaler. J Aerosol Med 2001 Winter; 14: 495–501
25. Zanen P, van Spiegel PI, van der Kolk H, Tushuizen E, Enthoven R. The effect of the inhalation flow on the performance of a dry powder inhalation systems. Int J Pharmaceut 1992; 81: 199– 203.
26. Chodosh S, Flanders JS, Kesten S, Serby CW, Hochrainer D, Witek TJ Jr. Effective delivery of particles with the HandiHaler dry powder inhalation system over a range of chronic obstructive pulmonary disease severity. J Aerosol Med 2001 Fall; 14: 309– 315.
27. Newhouse MT, Nantel NP, Chambers CB, Pratt B, Parry–Billings RN, Parry–Billings M. Clickhaler (a novel dry powder inhaler) provides similar bronchodilation to pressurized metered–dose inhaler, even at low flow rates. Chest. 1999; 115: 952– 956.
28. Fyrnys B, Stang N, Wolf–Heuss E. Stability and performance characteristics of a budesonide powder for inhalation with a novel dry powder inhaler device. Curr Opin Pulm Med 2001; 7(suppl 1): S7– S11.
29. Огородова ЛМ. Системы ингаляционной доставки препаратов в дыхательные пути. Пульмонология 1999; № 1: 84– 87.
30. Цой АН. Преимущества и недостатки приспособлений для индивидуальной ингаляционной терапии. Пульмонология 1997; № 3: 71– 74.
31. Nielsen KG, Auk IL, Bojsen K, Ifversen M, Klug B, Bisgaard H. Clinical effect of Diskus dry–powder inhaler at low and high inspiratory flow–rates in asthmatic children. Eur Respir J 1998; 11: 350– 354.
32. Muers M.F. Overview of nebulizer treatment. Thorax 1997; 52 (Suppl.2): S25– S30.
33. Sales–Girons J. Traitement de la phtisie pulmonaire par l’inhalation des liquides pulverises et apr les fumigation de gudron. Paris, F. Savy, 1859; p. 528.
34. Nikander K. Drug delivery systems. J Aerosol Med 1994; 7(Suppl 1): S19– 24
35. Muers M.F. The rational use of nebulizers in clinical practice. Eur. Respir. Rev. 1997; 7: 189– 197.
36. Авдеев С.Н. Использование небулайзеров в клинической практике. Русский Медицинский Журнал 2001; 9, № 5(124): 189– 196.
37. Loffert D.T., Ikle D., Nelson H.S. A comparison of commercial jet nebulisers. Chest 1994; 106: 1788– 1793.
38. Thomas S.H., O’Doherty M..J., Page C.J., Nunan T.O., Bateman N.T. Which apparatus for inhaled pentamidine? A comparison of pulmonary deposition via eight nebulisers. Eur.Respir.J. 1991; 4: 616– 622.
39. Knoch M., Sommer E. Jet nebulizer design and function. Eur.Respir.Rev. 2000; 10: 183– 186.
40. Jackson W.F., Nebulised Pulmocort therapy. A scientific and practical review. Clinical visison Ltd, Oxford 1998: p. 83.
41. Devadason S.G., Everald M.L., Linto J.M., Le Souef P.N. Comparison of drug delivery from conventional versus «Venturi» ulizers. Eur.Respir.J. 1997; 10: 2479– 2483.
42. Nicander K. Adaptive aerosol delivery: the principles. Eur.Respir.Rev. 1997; 7: 385– 387
43. Ganderton D. Targeted delivery of inhaled drugs: current challenges and future goal. J Aerosol Med 1999(Suppl 1) 12: S3– S8.
44. Dolovich MB. New propellant–free technologies under investigation. J Aerosol Med 1999; 12(Suppl 1):S9–S17.
Источник